
БЕЛКИ И БЕЛОК-МЕМБРАННЫЕ КОМПЛЕКСЫ
Атомно-силовая микроскопия
С помощью АСМ удается добиться атомного разрешения на твердой кристаллической поверхности, например пирографите [Binnig et al., 1987]. Однако при работе с “мягкими” биологическими объектами дело обстоит далеко не так хорошо. Одним из примеров молекулярного разрешения в АСМ на биологических объектах является изображение пленки Ленгмюра-Блоджет (ЛБ пленки) бегеновой кислоты (период 0,45 нм) и смешанных ЛБ пленок бегеновой кислоты и фермента глюкозы оксидазы на графите, позволяющих выявить отдельные молекулы глюкозы оксидазы и элементы их пространственной организации [Dubreuil et al., 1995] (рис. 1).
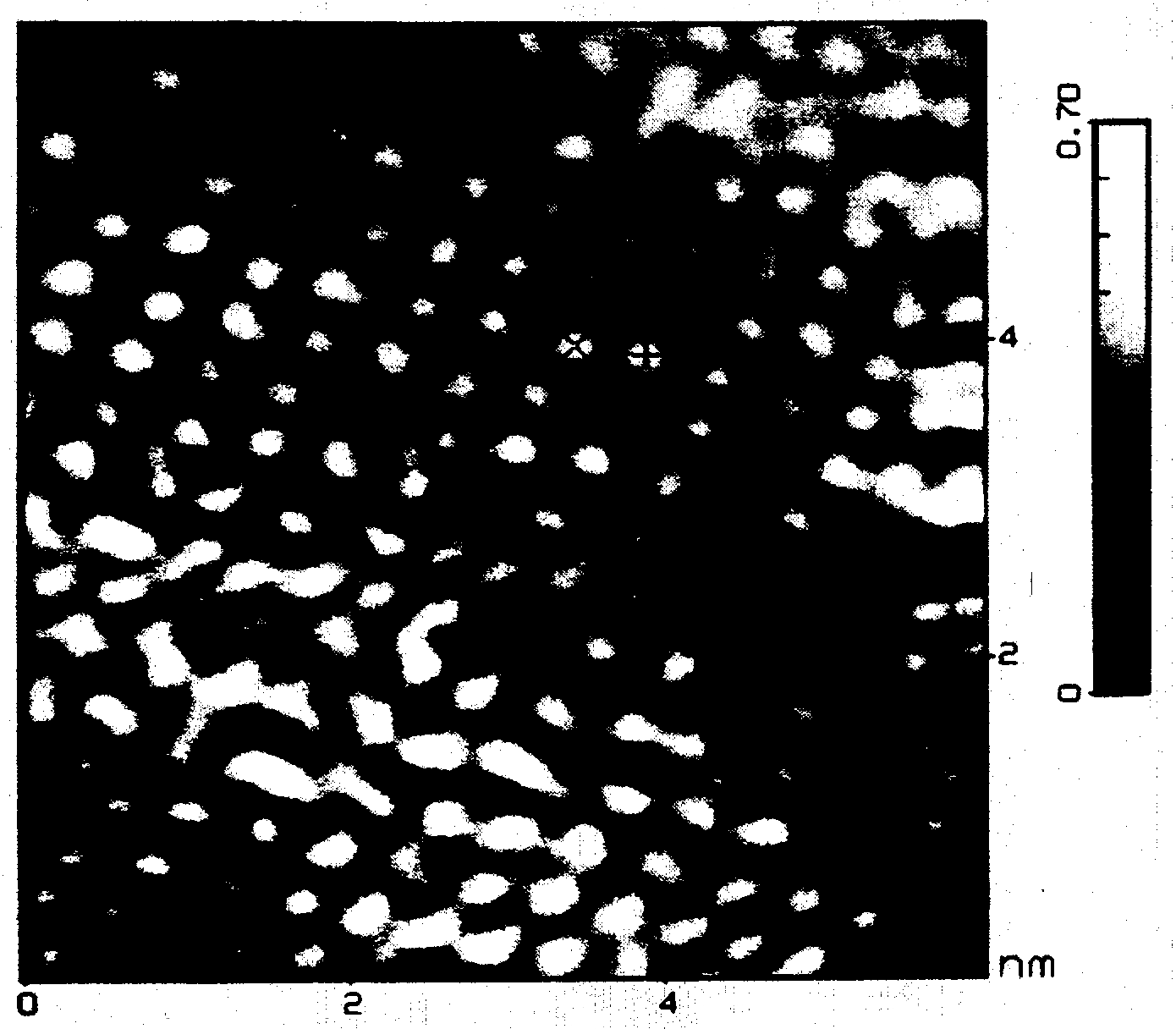 |
Рис. 1. АСМ-изображение смешанного бислоя
бегеновой кислоты и глюкозы оксидазы, перенесенного на графит Расстояние
между соседними молекулами 0,45 нм. Размер кадра 6´ 6 нм2 |
Авторы работы [McMaster et al., 1996] получили изображение периодической структуры газовых визикул из цианобактерий Anabaena flos-aquae в пропаноле, состоящих из блоков размером 4,6 нм. Детальный анализ изображений позволяет восстановить структуру визикул, согласующуюся с данными рентгено-структурного анализа.
Возможность применения АСМ для изучения белковых пленок на границе раздела сред после перенесения на подходящую подложку продемонстрирована в [Gunning et al., 1996]. Пленки бычьего сывороточного альбумина (БСА) переносили с плоской границы раздела гексадекан/вода, а b -казеина с границы вода/воздух на слюду. С помощью жидкостной ячейки образцы изучались в бутаноле. Пленка БСА представляет собой сеть, состоящую из глобулярных структур, размер которых (несколько нанометров) позволяет считать их отдельными молекулами белка. АСМ дает возможность исследовать внеклеточный матрикс непосредственно без фиксации, приготовления реплики, высушивания в критической точке, прокрашивания. С учетом формы и размеров острия, качество измерения ширины фибриллы можно считать близким к предельному - 8 нм при данных рентгеновского рассеяния 1,5 нм [Chernoff E.A., Chernoff D.A., 1992].
Сопоставление изображений в режимах постоянной высоты и силы трения помогает отличить особенности рельефа подложки от адсорбированных биологических объектов, если сила трения на последних отлична от силы трения на материале подложки. Особенно часто это используется при изучении мембран и ленгмюровских пленок липидов и других поверхностно активных веществ. В этом режиме наблюдали организацию в филаменты с-концевого фрагмена тау белка [Masai et al., 1996].
В контактном режиме из-за наличия латеральной составляющей прикладываемой силы адсорбированные на подложку биологические объекты при сканировании могут увлекаться острием, как бы счищаться. Устранение латеральных сил между образцом и зондом достигается в режиме прерывистого контакта: при сканировании игла зонда совершает дополнительные колебания по нормали к поверхности образца с амплитудой » 100 нм на частоте 100- 300 кГц. Измерение силы взаимодействия в режиме прерывистого контакта затруднено. Из механических деформаций мягких молекул ее можно приближенно оценить как не превышающую 200 пН [Fritz et al., 1995].
Уменьшение силы воздействиия на образец со стороны зонда достигается при наблюдении в жидкости. Погружение левера в жидкость имеет ряд преимуществ. Происходит уменьшение сил Ван-дер-Ваальса, исчезают капиллярные силы, вносящие основной вклад во взаимодействие зонд/образец в воздушной среде. При наблюдении в жидкости удается избежать типичных загрязнений поверхности образца при его высушивании от раствора. Однако здесь самое важное для биолога - это возможность исследовать биологически важные процессы in vitro и на границе раздела жидкость/твердое тело.
Было замечено, что левер в процессе работы в этом режиме очищается от органического загрязнения. При вибрации налипший материал стряхивается или остается на поверхности, когда острие соприкасается с ней [Hansma et al., 1994].
Сочетание режима прерывистого контакта с наблюдениями в жидкой среде позволяет минимизировать силы воздействия на поверхность образца. В этом случае отпадает необходимость в специальной фиксации биообъекта. Его закрепление на подложке происходит за счет физадсорбции. Вследствие этого возможная деформация биообъекта, вызванная силами, действующими со стороны подложки, уменьшена.
При прямой адсорбции молекул белка на подложку горизонтальные размеры в режиме прерывистого контакта получаются завышенными из-за уширения, вызванного конечным радиусом кривизны зонда, как и в контактной моде. Например, для толщины фибриллы G-актина данные рентгеновской кристаллографии составляют 5,5 нм, а при адсорбции на подложку в буферном растворе на АСМ-изображении в режиме прерывистого контакта фибриллы уширены до 15 нм [Fritz et al., 1995].
Кажущаяся высота молекул белка в режиме прерывистого контакта также оказывается завышенной, тогда как в контактном режиме она, как правило, занижена или близка к ожидаемой. Так, для адсорбированного на слюде лизоцима в режиме прерывистого контакта в жидкости она составляет 6- 8 нм против ожидаемых 3 нм в контактном [Fritz et al., 1995]. Существует несколько возможных объяснений этого эффекта.
Во-первых, кажущееся изменение высоты может быть обусловлено упругими свойствами мягких белков. Представим себе мысленный эксперимент. Пусть левер сканирует над физически однородным образцом, где присутствует только топографический рельеф. При приближении к возвышению расстояние между острием зонда и поверхностью сокращается, вызывая снижение амплитуды резонансных колебаний левера. Тогда пьезокерамика будет удалять образец от левера до тех пор, пока не будет восстановлено прежнее значение амплитуды. Теперь вообразим себе топографически однородный образец, включающий область, где сильно притяжение между поверхностью и зондом. Над этой областью зонд будет притягиваться к образцу, что вызовет уменьшение зазора между ними и, как следствие, снижение амплитуды колебаний. Обратная связь начнет удалять образец, и на изображении это будет выглядеть как наличие в данной области топографического возвышения. Если белок адсорбирован на слюде, то областям топографических неровностей присущ отличный от подложки характер взаимодействия с острием зонда. Таким образом, изображение в режиме прерывистого контакта отражает не только топографическую картину, но и характер сил взаимодействия между образцом и зондом одновременно.
Во-вторых, взаимодействие между зондом и образцом может быть вызвано локальным изменением заряда из-за электростатических свойств белка.
В-третьих, не исключено, что белки непрерывно движутся с характерным временем порядка миллисекунд, что близко к периоду резонансных колебаний левера. При работе с белками не стоит забывать, что белок не является неподвижной системой, и каждой молекуле присущи собственные внутренние движения. Если отключить сканирование вдоль медленной оси, можно построить временную зависимость высоты белков, адсорбированных на подложке [Thomson et al., 1996]. Размер флуктуаций оказывается больше, чем в случае просто мягкого материала подложки. Это свидетельствует о том, что флуктуации вызваны не только взаимодействием зонда и образца, как в случае мягкого материала, а изменением состояния белковой молекулы, ее собственным движением.
В-четвертых, белок может быть окружен шубой слабо адсорбированных ионов и молекул, что приводит к увеличению кажущихся размеров.
Однако по сравнению с режимом прерывистого контакта, контактный режим гораздо проще в обращении и настройке, используемые левера значительно дешевле, а главное он позволяет получать хорошие изображения при сканировании с большей частотой 5- 15 Гц, в зависимости от размера кадра (для сравнения в режиме прерывистого контакта скорость сканирования обычно ограничена 1,5 Гц), что не только существенно экономит время экспериментатора, но и позволяет регистрировать изменения, происходящие в образце за меньшие промежутки времени.
В бесконтактном режиме используется тот же принцип, что и в режиме прерывистого контакта, с той лишь разницей, что в нижней точке колебания зонд не касается образца. Так как зонд и образец не находятся в прямом контакте, горизонтальные силы, могущие привести к разрушению, практически отсутствуют. Расстояние между образцом и зондом (обычно 3- 5 нм) выбирают так, чтобы, с одной стороны, обеспечить достаточную величину силы притяжения, а с другой - не допустить разрушительного столкновения зонда с образцом.
Выявить преимущества бесконтактного режима по сравнению с контактным позволяет сопоставление качества изображения и разрешения на одних и тех же образцах [Braunstein, 1995]. Для филаментов F-актина завышенная ширина (около 20 нм) по сравнению с данными электронной микроскопии (7- 8 нм) в бесконтактном режиме несколько меньше, чем в контактном, а полученное значение шага спирали значительно ближе к этим данным.
В контактном режиме асимметрия и дефекты зонда сильно сказываются на его разрешающей способности. Так, для тех же F-актиновых филаментов [Braunstein, 1995] разрешение элементов спирали в одном и том же кадре зависело от угла между филаментом и направлением сканирования. При изгибе филамента разрешение могло ухудшиться или вовсе исчезнуть. В бесконтактном же режиме этот эффект значительно слабее, что свидетельствует о меньшем влиянии формы зонда на разрешающую способность.
Так как сила притяжения гораздо слабее, чем сила отталкивания, для детектирования сигнала требуется дополнительное усиление, приводящее к повышению уровня шума. Кроме того, работа в этом режиме часто оказывается нестабильной, так как левер может “залипнуть”. Значение градиента силы в бесконтактном режиме часто превышает величину константы жесткости левера, что приводит к нестабильности при регистрации отклонения. Для сведения нестабильности к минимуму применяются левера с большой константой жесткости (100 Н/м), что, в свою очередь, снижает чувствительность прибора [Yang et al., 1994a].
Изолированные белки
Естественным окружением огромного количества белков является вода или растворы солей. Для наблюдения в АСМ молекулы белков должны быть иммобилизованы на твердой подложке. Современная техника АСМ позволяет работать с поверхностью, погруженной в жидкость, и при приготовлении образцов вовсе не подвергать высушиванию исследуемый объект. Поэтому основным достоинством такого подхода при работе с водорастворимыми белками является возможность помещения их в условия, максимально приближенные к нативным.
Не менее существенным преимуществом жидкой среды оказывается значительное снижение контактных сил до величин менее 0,1 нН. При этом уменьшается воздействие на объект со стороны острия, и для многих биологических объектов удается получить качественные изображения. Однако даже при таких малых силах очень сложно наблюдать слабо адсорбированные молекулы в контактной моде, особенно в буферных растворах, так как при движении зонда сохраняются латеральные (лежащие в плоскости образца) силы трения. Молекулы часто увлекаются острием, что мешает их визуализации и, кроме того, может приводить к загрязнению острия, и, следовательно, потере разрешения. Применение режима прерывистого контакта особенно эффективно при исследовании адсорбированных белковых молекул, так как в этом случае они “закреплены” слабее, чем при ковалентной пришивке или в составе ленгмюровских пленок или мембран. В режиме прерывистого контакта можно получить изображения отдельных адсорбированных молекул на слюде. Комплексы цитохрома Р450 2В4 и NADPH-P450 редуктазы показаны на рис. 2.
 |
Рис. 2. Комплексы цитохрома Р450 2В4 и NADPH-P450
редуктазы на слюде
|
Тем не менее, специально разработанные методы приготовления объекта наблюдения помогают избежать проблемы иммобилизации и в контактном режиме. Так, например, разработан интересный метод ковалентной пришивки исследуемого белка к перенесенным на подложку искуственным липидным мембранам [Weisenhorn et al., 1990].
Помимо возможного улучшения качества изображения работа в жидкости открывает новые возможности для наблюдения биологических процессов in vitro. Например, самосборку филаментов из мономеров актина in vitro удалось наблюдать, используя в качестве подложки слюду [Weisenhorn et al., 1990]. Самосборка актиновых филаментов происходит в присутствии заряженных мембран, в условиях, при которых в объеме полимеризация не наблюдается. Известно, что плотность поверхностного заряда на слюде сравнима с поверхностной плотностью отрицательного заряда липидных мембран. Наблюдение процесса образования монослоев IgG на поверхности слюды при его сорбции из раствора указывает на существование латеральных сил взаимодействия между соседними молекулами IgG [Lin et al., 1990]. Это не является неожиданным, так как этот белок склонен к самоагрегации. В режиме прерывистого контакта в жидкости стала возможной не только визуализация адсорбированных на слюде молекул лизоцима, но и прямое наблюдение его ферментативной активности [M. Radmacher, M. Fritz, H.Hansma, P.Hansma, 1994].
Так как электростатическая компонента силы взаимодействия между левером и поверхностью образца является одной из важнейших компонент и во многом определяется поверхностной плотностью электрического заряда, экранирование поверхностных зарядов можно считать одним из самых эффективных приемов для получения стабильных АСМ-изображений в водных растворах.
Погашение зарядов на границе раздела пленок отрицательно заряженного ферритина и положительно заряженного полипептидного монослоя поли-1-бензил-L-гистидина (PBLH) - один из примеров такого рода [Onishi et al., 1993]. Создание такого эффекта “самоэкранирования” зарядов, содержащихся в самом образце, позволяет снизить силу взаимодействия между зондом и образцом до величины значительно меньшей, чем 10-10 Н, что дает возможность получать воспроизводимые устойчивые изображения двумерной упорядоченной решетки молекул ферритина в буферном растворе (рис. 3).
|
|
Рис. 3. Гексагональная плотная упаковка молекул ферритина
(а, б) и области с упаковкой неоднородного характера (в, г) Изображения
получены в контактном режиме. |
С этой точки зрения приготовление образца с использованием эффекта “самоэкранирования” - один из наиболее подходящих метполучения АСМ изображений водорастворимых белков. Этим же методом изучали структуру двумерного кристалла каталазы [Onishi et al., 1996]. Отрицательно заряженные молекулы каталазы электростатически связываются с положительно заряженным PBLH.
Известно, что отрицательно заряженные молекулы слабо адсорбируются на слюду, которая в воде тоже отрицательно заряжена [Butt et al., 1990]. Так как пурпурные мембраны отрицательно заряжены при нейтральном рН, для их иммобилизации на слюде требуется компенсация заряда путем подбора соответствующего рН [Butt et al., 1990].
При рассмотрении водорастворимых белков стабилизирующий эффект липидного бислоя отсутствует, и экспериментатору остается надеяться только на прямое взаимодействие между макромолекулами и подложкой. Из-за довольно большой силы, действующей со стороны зонда (в пределах единиц наноньютонов), и термических флуктуаций при комнатной температуре прямая адсорбция не всегда оказывается достаточной для наблюдения белков в АСМ. Для преодоления этих сложностей было предложено несколько методик: пришивка к искусственному молекулярному слою, модификация белка таким образом, чтобы он мог связываться со специально приготовленными подложками [Weisenhorn et al., 1990]. Однако такой подход является материалоспецифичным и, что хуже всего, изменяет структуру белка. В связи с этим, особенную важность имеет подбор экспериментальных условий для прямой адсорбции.
Одной из лучших подложек не только для иммобилизации мембран, но и для прямой адсорбции макромолекул является слюда. Многочисленные эксперименты свидетельствуют о том, что наилучшие результаты дают образцы, где слюда покрыта одним сплошным или неполным слоем макромолекул. Подобное покрытие достигается подбором концентрации раствора и времени сорбции для каждого конкретного случая [Onishi et al., 1993]. Если же подложка покрыта несколькими слоями, то слабо связанные молекулы в верхних слоях налипают на зонд, создавая большое количество артефактов. Налипание исследуемого вещества на зонд является неконтролируемым процессом, что ставит перед экспериментатором задачу поиска новых материалов для изготовления зондов.
Однако в ряде случаев присутствие жидкости приводит к повреждению образца или подложки [Gathercole et al., 1993].
Мембранные белки
Работы по наблюдению мембранных белков в АСМ были начаты с наиболее хорошо изученных ранее объектов. Одним из первых стало исследование нативных пурпурных мембран Halobacterium halobium [Worchester et al., 1988] и визуализация пространственной двумерной решетки бактериородопсина [Worchester et al., 1990].
С развитием экспериментальной техники удалось достичь дальнейших успехов в этой области. Разрешения, даваемого АСМ на воздухе в режиме модуляции силы на образцах, приготовленных из фотосинтетических мембран (хроматофоров), достаточно для визуализации отдельных фотореакционных единиц, удаленных друг от друга на расстояние 10- 12 нм [Yamada et al., 1995]. Однако оно не позволяет различить внутри фотореакционной единицы более мелкие детали, например, сам реакционный центр. Контактный режим (режим постоянной силы) позволяет определить толщину мембраны и мембраны со встроенными белковыми единицами, но не дает возможности их разрешить.
При погружении образца АСМ в жидкость становится возможным не только определить толщину пурпурной мембраны, но и проследить ее зависимость от pH окружающего раствора [Muller et al., 1995]. Кроме того, при правильном выборе экспериментальных условий разрешение улучшается до 0,7 нм, что позволяет разрешить структуру фотореакционной единицы, различая составные части, отстоящие друг от друга на расстояние 1,45 нм (рис. 4).
 а а |
|
Рис. 4. Топография поверхности пурпурной
мембраны, полученная на АСМ с высоким разрешением
а - воспроизводимая субструктура тримеров бактериородопсина;
б - среднее по четырем независимым кадрам;
в - результат симметризации третьего порядка.
Высота рельефа составляет 0,41 нм. Масштабный отрезок соответствует 20 нм для
а, 4 нм для б, в
Наблюдаемая толщина пурпурной мембраны зависит также от выбора подложки, что вызвано, видимо, различным взаимодействием между левером и подложкой [Butt et al., 1990].
Хотя разрешения, даваемого АСМ, далеко не всегда достаточно для разрешения структуры белковой молекулы, оно оказывается достаточно хорошим для изучения процессов образования белковых кластеров в фосфолипидных слоях на твердой подложке. Так, продолговатые кластеры грамицидина А, образовавшиеся в бислоях насыщенного фосфатидилхолина, наблюдали в растворе соли при комнатной температуре [Mou et al., 1996]. Удалось обнаружить разницу толщины липидного бислоя в непосредственной близости от грамицидиновых кластеров и в областях, свободных от пептида.
При исследовании структуры и структурных изменений мембранных белков, например, рецепторов и каналоформеров, не образующих периодических структур в мембране и плохо кристаллизующихся, методы зондовой микроскопии обладают явными преимуществами над методами рентгеноструктурного анализа и электронной микроскопии.
Структуру pertussis toxine наблюдали в АСМ в буферном растворе [Yang et al., 1994б]. Диаметр отдельной субъединицы равен примерно 2 нм. Сравнивая изображения интактного токсина и его В-олигомера, авторы установили, что А-субъединица расположена в центре и окружена еще пятью субъединицами. Из-за неизвестного и переменного вертикального сжатия не удалось установить объемные соотношения между ними. Уширение, даваемое зондом, очень невелико в сравнении с ранее полученными данными [Hoh et al., 1993].
Аналогичной структурой обладает другой важный мембранный белок - cholera toxine (рис. 5). Пентамерная структура его В-олигомера, связанного с ганглиозидами, разрешена с помощью АСМ в слабом растворе соли [Yang et al., 1993]. При визуализации полной молекулы этого токсина не удалось разрешить расположенную в центре А-субъединицу.
 а а |
Рис. 5 (а, б). Мембранный белок cholera toxine. В-субъединицы
cholera toxine |
Дополнительным преимуществом обладает использование ковалентных поперечных сшивок в обоих слоях бислойной липидной мембраны на твердой подложке. При этом повышается стабильность и, возможно, разрешение. Латеральная подвижность встроенных мембранных белков ограничивается, так как отдельные молекулы липида оказываются пространственно зафиксированными [Yang et al., 1993]. Кроме того, такой подход позволяет добиваться молекулярного разрешения на самом липидном бислое при работе в жидкости.
Если мембранный белок образует двумерную упорядоченную структуру, к тому же обладающую симметрией вращения, существенную помощь исследователю оказывают корреляционные методы. Гексагонально упакованный промежуточный белковый слой (HPI слой) - природный двумерный кристалл белка, покрывающего поверхность бактерии Deinococcus radiodurans, изучался в АСМ не в жидкости, но в условиях гидратации [Wiegrabe et al., 1991]. Полученное разрешение дает возможность определить период, однако оно хуже, чем для СТМ и ТЭМ. Если при визуализации этого же объекта работать в буферном растворе, а при обработке изображений применить усреднение корреляционными
 |
г |
Рис. 5 (в, г). в - трехмерное изображение молекул cholera toxine; г - трехмерное изображение его B-субъединиц Изображение получено в режиме постоянной силы в слабом растворе соли |
методами, а также подвергнуть отдельную ячейку симметризации вращения шестого порядка, полученное изображение не уступит по качеству данным ТЭМ [Karrasch et al., 1994].
Еще одним примером получения молекулярного разрешения с применением фильтрации, усреднения между ячейками и симметризации вращения третьего порядка является АСМ-визуализация бактериородопсина в пурпурных мембранах в буферном растворе [Butt et al., 1990].
АСМ позволяет работать с целыми клетками и участками клеточных мембран. Изображение внеклеточной поверхности межклеточных соединительных пор получено в буферном растворе [Hoh et al., 1993].
 |
Рис. 6. АСМ-изображение внеклеточной
поверхности межклеточных соединительных пор в буферном растворе |
На внеклеточной поверхности наблюдали гексагональную решетку, состоящую из отдельных межклеточных каналов с расстоянием между центрами 9,4 нм (рис. 6). Частицы размером 40- 80 нм, возможно, имеют белковую природу, их кластеры наблюдали на поверхности целого нейрона [Umemura et al., 1993].
Белковые кристаллы и их рост
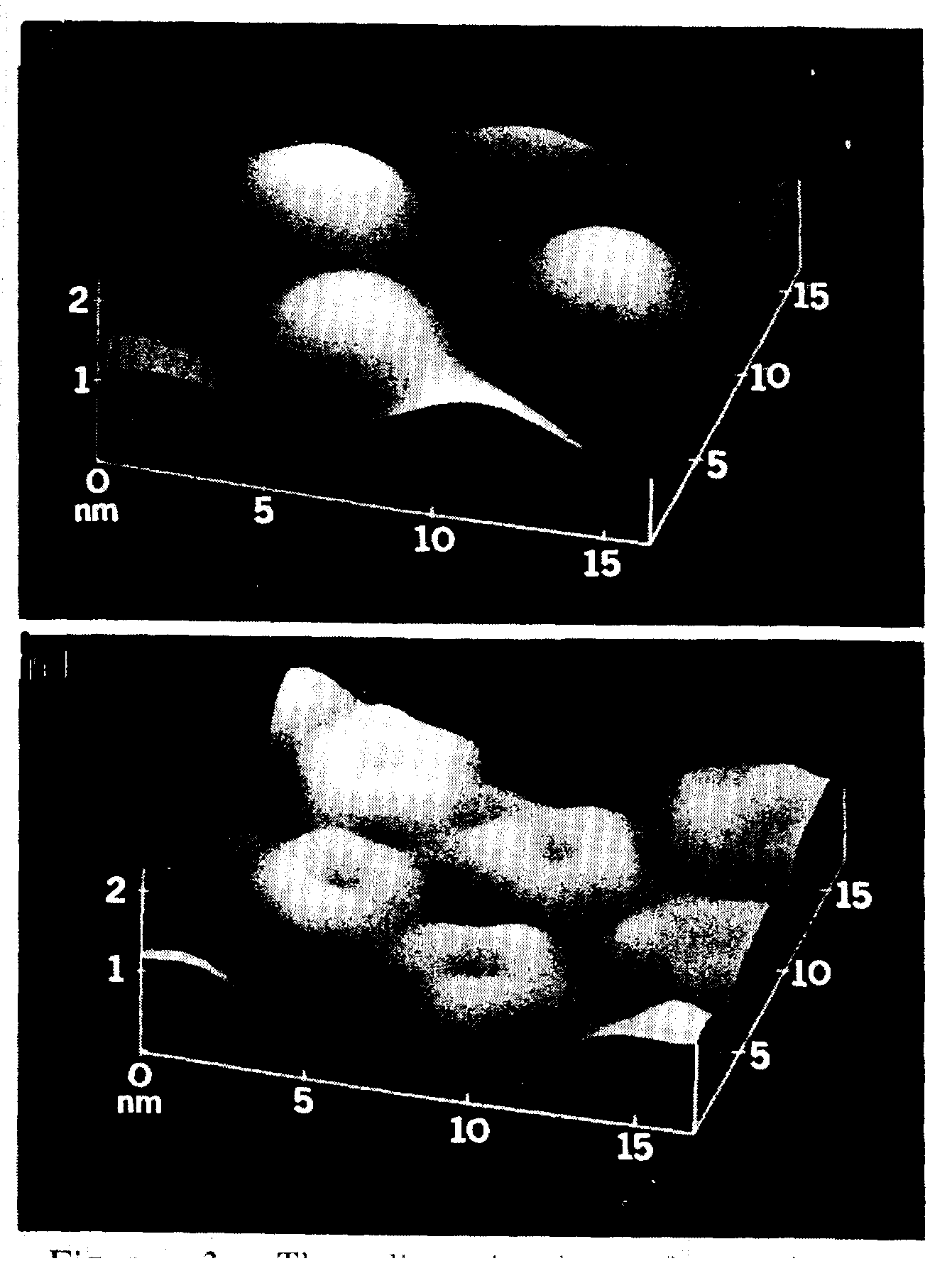
АСМ нашел широкое применение для изучения белков в кристаллическом виде. С помощью АСМ удалось наблюдать даже процесс роста кристаллов лизоцима [Durbin, Carlson, 1992], канавалина [McPherson et al., 1995; Land et al., 1995] и тауматина [McPherson et al., 1995]. АСМ является единственным методом, который позволяет не только добиться высокого разрешения, что возможно и в электронной микроскопии, но и видеть сам процесс роста непосредственно in situ (рис. 7).
 а а |
 б б |
Рис. 7. Единичный кристалл из молекул лизоцима
а - топографическое изображение;
б - изображение с применением боковой подсветки.
Режим постоянной силы.
Размер кадра 5´ 4 мкм2. Высота
отдельной ступеньки соответствует моно-слою ("4 нм).
Заимствовано из работы Л.Н. Рашковича и др. [Рашкович и др., 1998]
Кроме того, высокая точность позиционирования АСМ позволяет последовательно получать изображения одних и тех же площадок размером порядка микрона на протяжении нескольких дней и, таким образом, контролировать медленно протекающие процессы распространения ступенек, раскручивания спиралей и образования новых поверхностей.
Одной из причин, по которой не всегда удается добиться молекулярного разрешения на АСМ-изображениях кристаллов белков, считается их относительная мягкость и постоянное движение. Молекулы на поверхности не так сильно связаны, как в объеме и, возможно, имеют больший диапазон для движения. Если масштаб таких временных изменений высоты сравним с размером пространственных изменений высоты поверхности, молекулярное разрешение может оказаться недостижимым [Durbin, Carlson, 1992].
Несмотря на это, для кристаллов лизоцима, канавалина и тауматина молекулярное разрешение в АСМ было получено [Konnert et al., 1994; Kuznetsov et al., 1997]. Такие данные имеют значение для изучения динамики роста кристаллов, так как АСМ в настоящее время является единственным методом, позволяющим исследовать формирование кристалла, образование дефектов, скорость роста и ее зависимость от направления на уровне отдельных молекул, т.е. отдельной ячейки, что недоступно интерференционным методам. Кристалл белка является модельной системой для изучения кристаллов любой природы, обладая тем преимуществом, что относительно большие размеры одной молекулы (десятки нанометров) позволяют наблюдать их в АСМ с молекулярным разрешением.
Измерение сил межмолекулярного взаимодействия
Помимо прямой визуализации биологических структур АСМ открывает новые возможности их изучения, недоступные другим методам. Например, непосредственное измерение сил адгезии между лигандами и рецептором, в частности, биотином и стрептавидином [Lee et al., 1994; Moy et al., 1994], путем регистрации зависимости отклонения левера от расстояния до поверхности. Отрыв левера от поверхности происходит в момент, когда сила адгезии достигает максимального значения. Полученная величина силы составляет десятые доли наноньютона, что достаточно для надежной регистрации в АСМ. Авторы работ [Lee et al., 1994; Moy et al., 1994] впервые измерили силу взаимодействия между парой поверхностей, покрытых биотином, поверхностями, покрытыми биотином и стрептавидином, а также одной поверхностью, покрытой биотином, а другой - биотином со связанным стрептавидином. Для этого к леверу прикрепляли стеклянный микрошарик, который, как и подложку из слюды, покрывали биотином и стрептавидином. При этом использовалась их ковалентная пришивка к молекулам бычьего сывороточного альбумина (БСА), которые, в свою очередь, неспецифически и необратимо адсорбируются к стеклу и слюде. Отсутствие остаточных сил притяжения между двумя биотинированными поверхностями делает их подходящими для измерения силы взаимодействия между биотином и стрептавидином.
Аналогичным образом можно использовать антитело в качестве сенсора на антиген и регистрировать узнавание антигена антителом [Hinterdorfer et al., 1996]. Кривая зависимости силы от расстояния при приближении зонда с антителом к поверхности, покрытой антигеном, имеет характерную форму, из которой можно получить информацию об узнавании и связывании одной единственной пары антиген/антитело, а из обратной ветви кривой определить величину силы их взаимодействия.
Констатировать связывание антитела с антигеном без применения меток можно и с помощью непосредственной АСМ-визуализации комплексов антиген/антитело. Так, при специфическом связывании имунноглобулина G с иммобилизованным на подложке БСА топография поверхности существенно отличается от случая неспецифических антител или чистого БСА [Browning-Kelley et al., 1997].
Количественно охарактеризовать специфические иммунологические реакции с помощью АСМ помогает определение шероховатости поверхности с использованием такого параметра, как среднеквадратичное отклонение высоты поверхности от среднего значения [Perrin et al., 1997]. Количество образовавшихся комплексов антиген/антитело в зависимости от концентрации антигена в растворе можно определять по увеличению шероховатости поверхности, покрытой иммобилизованными антителами, на которую наносят исследуемый раствор. На этой основе создан биосенсор, позволяющий детектировать концентрации ферритина до 0,06 мкг/мл [Perrin et al., 1997].
Снимая силовую кривую в каждой точке исследуемой поверхности, можно определить максимальную величину силы адгезии зонда к образцу. На этом принципе был сконструирован АСМ, позволяющий составлять карту величины сил адгезии на данной поверхности [Van der Werf et al., 1994].
Для молекул лизоцима и их агрегатов, адсорбированных на слюду, были получены такие карты сил адгезии и величины модуля упругости [Radmacher, Fritz, Cleveland et al., 1994]. Адгезия, определяемая по величине гистерезиса, оказалась для слюды большей, чем для лизоцима. На кривых снятых в области, где адсорбирован лизоцим, наблюдалось отклонение от линейности на участке, соответствующем контакту, вызванное упругой деформацией лизоцима. Отрыв левера от поверхности слюды происходит быстрее, чем от поверхности агрегата лизоцима. Величина, называемая скоростью отрыва левера, используется для подсчета вязкости лизоцима.
При работе с жидкими липидными пленками сила взаимодействия между зондом и образцом оказывается зависящей от скорости сканирования. Удачные, хорошо воспроизводимые изобрaжения получаются при скорости сканирования выше некоторого критического значения (в данном случае 6 мкм/с). Если скорость сканирования оказывается ниже, получить изображения не удается. Объяснение этого эффекта аналогично модели человека, скользящего на водных лыжах [Rдdler et al., 1994].
Последние достижения в этой области показывают, что в ближайшем будущем можно будет использовать АСМ для сверхчувствительного имунноаналитического детектирования без применения каких-либо меток как в качественных, так и в количественных исследованиях.
Туннельная микроскопия
Требование проводимости исследуемого в СТМ объекта сужает область его применимости по сравнению с АСМ. Однако адсорбция органических молекул на проводящую подложку в ряде случаев делает возможной визуализцию молекул вещества, не обладающего объемной проводимостью. Теоретическое обоснование таких экспериментальных фактов до сих пор остается предметом дебатов. Единой квантово-механической теории, объясняющей механизмы туннельной проводимости и формирования СТМ-изображений диэлектрических объектов, в настоящее время не существует, что сильно осложняет интерпретацию полученных данных. Для объяснения наблюдаемого эффекта авторы в каждом случае предлагают различные механизмы возникновения туннельного тока достаточной для регистрации величины (0,1- 1 нА). К сожалению, ни одна из предложенных моделей в полной мере не описывает происходящие процессы и не дает полного объяснения наблюдаемым явлениям. По всей видимости, в разных случаях природа и механизм возникновения тока различны, что не позволяет построить единую теоретическую модель наблюдения диэлектрических объектов методом СТМ.
Существующие модели формирования туннельных изображений можно разделить на несколько классов. Перечислим основные из них. Это резонансное туннелирование [Yuan, Shao, 1990; Keller et al., 1989; Lindsay et al., 1990], нерезонансное туннелирование [Michel et al., 1989], инжекция внешним полем [R. Garcнa, N. Garcнa, 1990], туннелирование через поверхностные состояния [Amrein et al., 1989; Garcнa et al., 1987], автоэлектронная эмиссия [Garcнa et al., 1995], электрический пробой [Tang et al., 1993], ионная проводимость адсорбированной пленки воды [Yuan et al., 1991; Guckenberger et al., 1994]. Последним механизмом наиболее часто пользуются для объяснения формирования низкотоковых изображений в условиях контролируемой влажности.
Сколь бы многообещающей ни была перспектива использования такого высокоразрешающего метода, как СТМ, для изучения структуры и электронных свойств биологических материалов, но при работе с биообъектами мы сталкиваемся с рядом существенных трудностей, вызванных свойствами именно самих биообъектов. Это прежде всего их низкая электрическая проводимость, существенная именно для СТМ и не играющая роли для АСМ. Кроме того, нельзя не отметить их мягкость и слабую адгезию к проводящей подложке, что препятствует их успешной визуализации, так как силы, возникающие в туннельном контакте, могут быть значительными. К осложняющим обстоятельствам также следует отнести трудности интерпретации изображений, так как внутренние движения и деформации приводят к смазыванию картины. Несмотря на вышеперечисленные обстоятельства, на настоящий момент уже достигнуты значительные успехи в этой области.
Одним из первых доказательств возможности использования СТМ для изучения белков стала визуализация на графите альбумина яичного куриного белка, сывороточного альбумина человека и фибриногена [Feng et al., 1989].
Низкая проводимость биообъектов диктует экспериментаторам необходимость уменьшать рабочее значение туннельного тока и/или повышать напряжение, прикладываемое к туннельному переходу. Сконструированы СТМ, работающие в низкотоковом режиме при рабочих значениях туннельного тока равных десятым долям пикоампер [Dunlap et al., 1993]. В условиях контролируемой влажности при таких значениях туннельного тока и величине напряжения на переходе до 10 В стала возможной визуализация HPI слоя Deinococcus radiodurans [Guckenberger et al., 1989] (рис. 8).
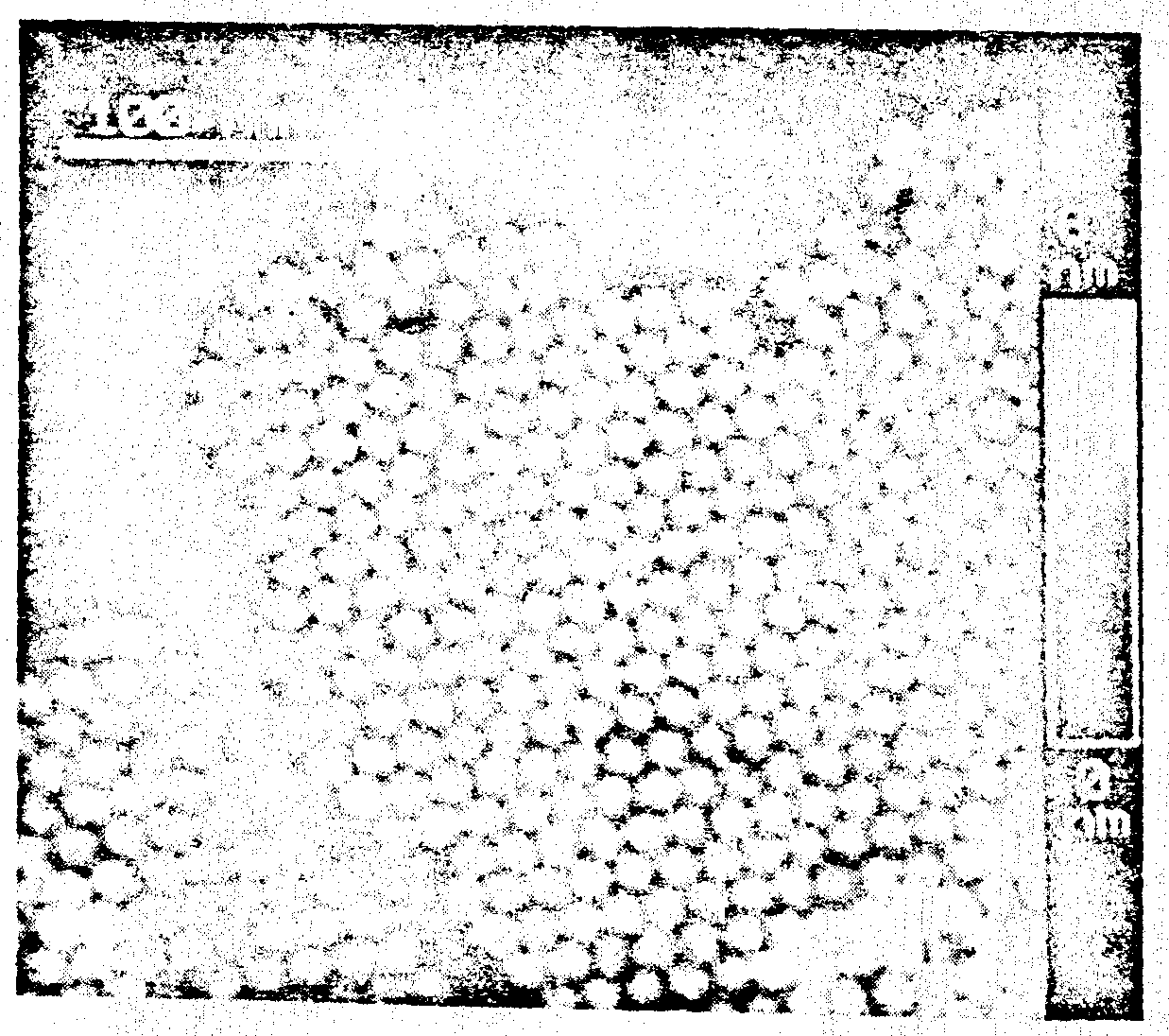 |
Рис. 8. Природный двумерный кристалл белка HPI слоя из Deinococcus radiodurans |
Одним из важнейших факторов, влияющих на качество СТМ изображений биообъектов, является контроль относительной влажности. Для Deinococcus radiodurans [Guckenberger et al., 1989] наилучшее изображение было получено при 35- 45%; при 25- 35% были обнаружены только его характерные черты, а периодическая структура вообще не наблюдалась. При влажности менее 10% вообще не было никаких следов присутствия HPI слоя. Такая зависимость указывает на то, что адсорбция воды гигроскопичным белком создает поверхностную проводимость. Это представляется тем более верным, если учесть, что толщина HPI слоя 7 нм весьма значительна для СТМ. Сама структура HPI слоя тоже удобна для СТМ, так как содержит много пор, создающих, возможно, дополнительные каналы проводимости между верхней частью слоя и подложкой [Guckenberger et al., 1989].
Требование проводимости ограничивает для СТМ выбор подложек по сравнению с АСМ. Адсорбция белковых молекул на проводящую подложку - один из простых и удобных способов их визуализации. Для получения качественных изображений, как правило, необходимо поддерживать такой образец влажным. Таким образом на графите получено СТМ-изображение комплекса recA-ДНК (рис. 9), на котором различимы отдельные recA-протомеры [Amrein et al., 1989].
 |
Рис. 9.
СТМ-изображение отдельного непокрытого комплекса recA-ДНК,
адсорбированного на проводящую подложку |
Несмотря на названные трудности, были достигнуты значительные успехи по СТМ-визуализации белковых структур. Сообщается о получении СТМ-изображения F1 комплекса субъединиц Н+-АТФазы термофильных бактерий, встроенного в липосомы [Masai et al., 1992]. Раствор липосом наносили на графит и высушивали. Везикулы, выделенные из нативных пурпурных бактерий, изучали с помощью СТМ на графитовой подложке [Golubok et al., 1992]. Авторы достигли пространственного разрешения, позволяющего различить отдельные белковые глобулы. Хотя гексагональная структура наблюдаемых кластеров соответствует существующей модели ячейки фоторецептора пурпурной мембраны, структуру самой ячейки разобрать на полученных изображениях невозможно. Упорядоченные, плотно упакованные полипептидные слои, различаемые авторами, содержат более 200 белков и имеют гексагональную структуру.
Функционально активные фрагменты выделенных из галобактерий пурпурных мембран, включающих бактериородопсин, также изучались в СТМ [Кононенко и др., 1990]. Диспергированные мембраны высаживали на графитовую подложку. Отчетливо видна гексагональная структура, состоящая из отдельных "пирамид", каждая из которых, видимо, представляет собой тример молекулы бактериородопсина. Среднее расстояние между кластерами несколько больше значений, полученных в дифракционных экспериментах, что можно объяснить "растеканием" по поверхности подложки за счет ван-дер-ваальсова притяжения.
Интересным наблюдением стало получение СТМ-изображений ацетилхолинового рецептора постсинаптической мембраны электрического органа Torpedo сalifornia [Bertazzon et al., 1992]. Молекула представляет собой пентамер с четырьмя основными и одним минорным возвышением над поверхностью, окружающими центральную "впадину”.
Если покрыть туннельную иглу диэлектрической пленкой, например парафином или лаком, оставив незаизолированным только самый кончик, можно работать, погрузив образец и иглу в жидкость. Такой подход открывает перспективы работы в условиях, максимально приближенных к нативным, и наблюдений биологически важных процессов in situ. В некоторых случаях это является необходимым условием получения хороших результатов.
Успешное наблюдение в СТМ целых хлоропластов [Dahn et al., 1992] возможно только в растворе буфера. На внешней поверхности хлоропластов наблюдается структура молекулярного масштаба. В некоторых областях она имеет почти периодический кристаллический вид. Причина этого пока не ясна, но это указывает на то, что мембранные белки образуют упорядоченную решетку хотя бы в некоторых областях мембраны.
Работа в электрохимической ячейке СТМ in situ позволила наблюдать при денатурации пероксидазы хрена смену глобулярной формы молекул V-образной [Zhang et al., 1996].
При работе с целыми клетками в физиологическом растворе проводимость оказывается недостаточной и острие проникает внутрь клетки и “показывает” мембранные структуры и элементы цитоскелета, которые расположены внутри клетки вплотную к части клеточной мембраны, обращенной к подложке [Ruppersberg et al., 1989].
Прямой адсорбции молекул белка на гидрофобную поверхность графита часто оказывается недостаточно для их СТМ-визуализации. Для иммобилизации на проводящей подложке белков разработаны специальные методы модификации подложек и ковалентной пришивки белков, позволяющие ограничить их подвижность и получить хорошее разрешение.
Одной из основных проблем при получении четких СТМ-изображений фосфолипидных монослоев, нанесенных по технологии Ленгмюра-Блоджет на поверхность графита, является, вероятно, их нестабильность, вызванная слабой адгезией. Недавно был предложен новый метод, включающий ковалентную пришивку фосфолипида к поверхности графита, который обеспечивает лучшую механическую стабильность, контроль ориентации и распределения, повышение разрешающей способности [Heckl et al., 1989]. Техника иммобилизации позволяет однозначно различать отдельные фосфолипидные молекулы на СТМ-изображениях, стабильных на протяжении часов, но достичь атомного разрешения все же не удается. Ковалентная пришивка изменяет нативную организацию липидного слоя и вместе с химической обработкой не позволяет использовать этот метод для исследования встроенных белков.
Мягкое электроокисление графита делает его поверхность гидрофильной и пригодной для СТМ-визуализации адсорбированного цитохрома с in situ [Zhang, Wang, 1997]. Методом электрохимического нанесения на такую поверхность готовили образцы для изучения на СТМ структуры свернутого и развернутого гемоглобина [Zhang et al., 1995].
Одним из основных преимуществ СТМ по сравнению с АСМ, безусловно, является лучшее разрешение. Помимо наблюдения атомарной структуры графита и жестких ЛБ пленок жирных кислот, получено молекулярное разрешение на упорядоченной ЛБ пленке соевого фосфатидилхолина (PC) на графите и пленки бактериородопсина в липидном матриксе на воздухе (рис. 10) [Niemi et al., 1993].
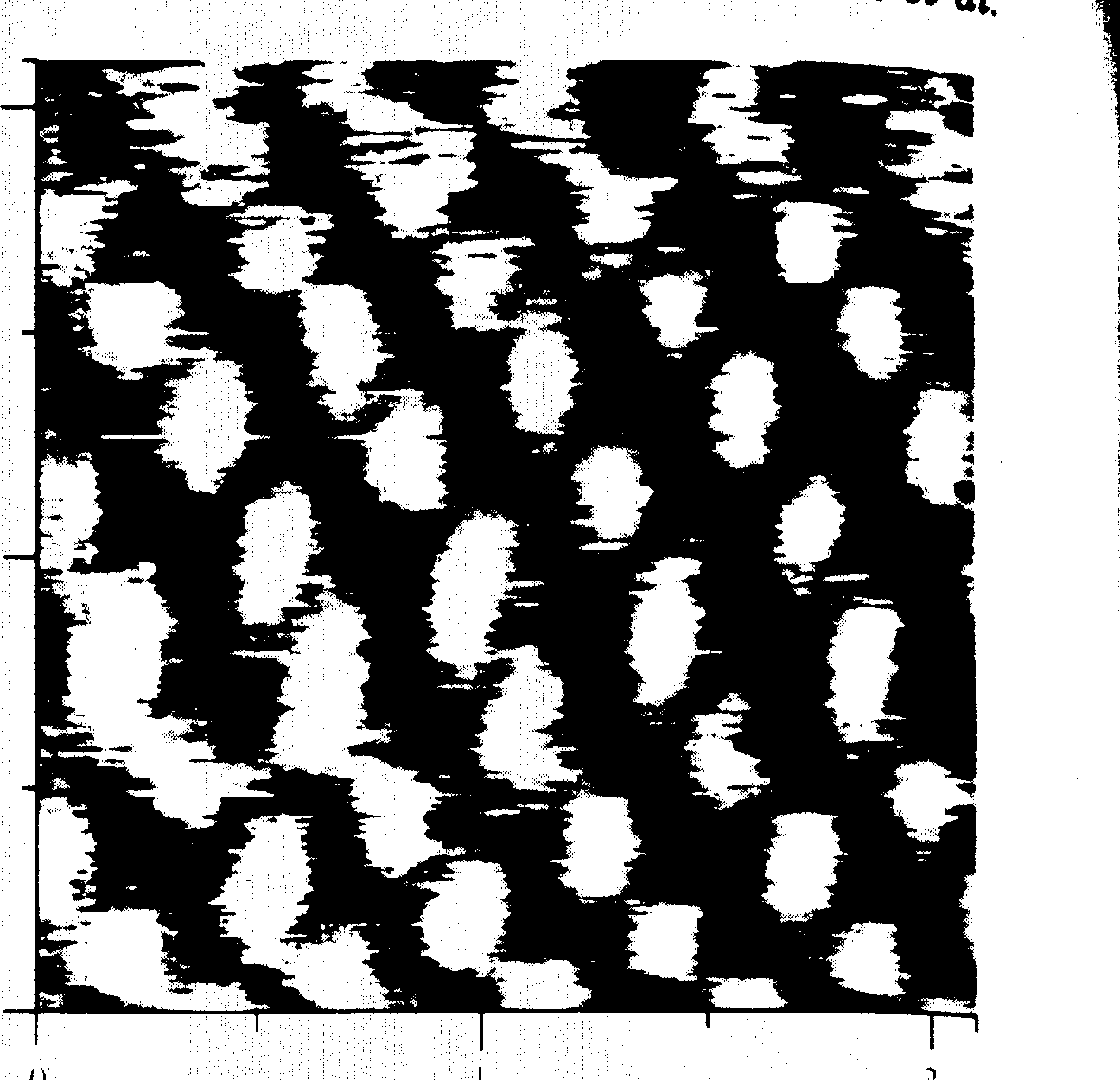 |
Рис. 10. Молекулярное разрешение на упорядоченном
участке бислойной пленки бактериородопсина в липидном матриксе Размер СТМ-изображения 2,14´ 2,14 нм2. Средние межмолекулярные растояния 0,33 и 0,37 нм. Величина туннельного напряжения 50 мВ, туннельного тока 1 нА |
Период упорядоченной решетки РС составляет 0,4 нм, тогда как наилучшее разрешение на подобных объектах в АСМ составляет 0,7 нм в жидкости. В АСМ детально не различима система полос в составе повторяющегося блока фибриллы кологена, хорошо различимая на тех же образцах в СТМ [Gathercole et al., 1993].
Тем не менее, разрешение СТМ для биологических объектов оказывается почти на порядок хуже, чем для неорганических кристаллов. Так, для киназы фосфорилазы это 0,3- 0,5 нм [Edstrom et al., 1989, 1990]. Это вызвано, по-видимому, внутренней подвижностью аминокислотных цепей, и при низких температурах ожидается значительное улучшение разрешения.
Еще одной иллюстрацией сравнения разрешающей способности СТМ и АСМ служит пример получения атомного разрешения ионного кристалла ферритина, наблюдаемого при повреждении туннельной иглой полипептидной оболочки [Yang et al., 1992]. АСМ позволяет видеть только полипептидную оболочку отдельных молекул этого белка (средний размер 15 мн) (см. раздел “Изолированные белки”). Размер ячейки наблюдаемого в СТМ кристалла 0,5´ 0,5 нм2 (рис. 11), а проекция комплекса О2-/Fe3+ демонстрирует гексагональную решетку 0,15´ 0,15 нм2.
Высота адсорбированных биообъектов, как правило, оказывается меньше реальной. Например, для киназы фосфорилазы высота составляет 30% от измеренной независимым методом [Edstrom et al., 1990]. Помимо
 |
Рис. 11. Типичное СТМ-изображение молекулы ферритина с частично разрушенной
оболочкой. Гексагональная решетка с периодом 0,49 нм хорошо разрешена.
|
Нельзя также не отметить неизбежно присутствующее и в АСМ возможное поперечное уширение, создаваемое иглой. Так, кажущаяся ширина фибриллы коллагена в СТМ составляет 3 нм вместо предсказываемых моделью 1,5 нм [Zhu et al., 1991].
Помимо получения изображений на молекулярном уровне, СТМ позволяет осуществлять микроманипулирование объектами. Эффект электростатического притяжения можно использовать для извлечения отдельных биомолекул и помещения на выбранный чистый участок подложки [Alekperov et al., 1989]. Повышение отрицательного напряжения на игле до - 1,5 В вызывает вырывание молекулы из кластера на подложке. Последующее снижение до - 0,3 В позволяет осадить ее после переноса в желаемое место. Понижение температуры до 15- 80 К повышает стабильность молекул и точность позиционирования, облегчая создание наноструктур [Meyer et al., 1996].
При визуализации Halobacterium halobium [Tamayo et al., 1995] увеличение туннельного тока до 20 пА привело к тому, что мембрана не в состоянии пропускать носители и приближаемая обратной связью игла протыкает мембрану, оставляя при быстром сканировании вырезанную метку. При медленном сканировании наблюдается эффект саморепарации мембраны. Если она не сидит на ступеньках графита, такое манипулирование приводит к ее разрыву.
Возможность обходиться без металлического запыления образца в СТМ и АСМ является одним из главных преимуществ перед просвечивающей и сканирующей электронной микроскопией. Однако в ряде случаев, когда при работе с биологическими объектами их собственной проводимости недостаточно, одним из путей преодоления этого служит металлическое запыление. Хотя такой подход неизбежно приводит к потере латерального разрешения, он улучшает разрешение в направлении, перпендикулярном плоскости образца. Запыленная поверхность становится однородной по своим электронным свойствам. При этом исчезает вклад в формирование рельефа, даваемый различием локальной плотности электронных состояний вблизи уровня Ферми чистой подложки и подложки с адсорбированными объектами, что существенно упрощает интерпретацию данных, позволяя однозначно определить высоту объекта.
Применение металлического напыления дает возможность с помощью не только АСМ, но и СТМ с субнанометровой точностью количественно характеризовать толщину планарной пурпурной мембраны и детектировать изменения ее толщины после обработки ферментами [Fisher, Whitfield et al., 1990; Fisher, Yanagimoto et al., 1990].
Пожалуй самым существнным и принципиальным преимуществом СТМ перед АСМ является возможность изучения электронных свойств белков и мембран. Производная туннельного тока по напряжению на переходе пропорциональна локальной плотности электронных состояний вблизи уровня Ферми. Динамический режим СТМ позволяет исследовать электронную структуру системы, определять ширину запрещенной зоны, работу выхода и другие электронные свойства.
При адсорбции реакционных центров фотосистемы I хлоропластов шпината на золото вольт-амперная характеристика была типична для полупроводников с запрещенной зоной [Lee et al., 1995]. Измеренная ширина запрещенной зоны соответствовала области сильного оптического поглощения. При обработке реакционных центров платиной наблюдалась зависимость контраста изображения от полярности туннельного напряжения, а асимметричная вольт-амперная характеристика напоминала характеристику допированного полупроводника n-типа, что и объясняет асимметрию протекания туннельного тока по отношению к полярности напряжения.
Выделенные фотосинтетические реакционные центры из Rhodobacter sphaeroides наблюдали на графите [Alekperov et al., 1989]. Анализ вольт-амперных характеристик реакционных центров на свету и в темноте показал наличие в темноте резонансного пика, соответствующего разности потенциалов 3,16 В. Наличие пика характеризует функциональные свойства реакционных центров, а именно: перенос электронов с бактериородофилла на хинон [Facci et al., 1994]. Это доказывает возможность индуцировать перенос электронов даже при отсутствии излучения путем приложения соответствующей разности потенциалов.
Асимметрия процесса протекания туннельного тока через молекулы цитохрома Р450 2В4, встроенные в липосомы, показана в [Uvarov et al., 1996]. При отрицательном напряжении на игле молекулы белка видны как выступающие над поверхностью липосом, а при смене полярности - как углубления. Плотность электронных состояний вблизи уровня Ферми для липосомы на графите, а следовательно, и вольт-амперная характеристика, также оказывается асимметричной по отношению к знаку приложенного напряжения [Gallyamov et al., in press]. Полученные данные указывают на сходство электронной структуры рассматриваемой системы с электронной структурой допированных полупроводников.
Принципиально новым в подходе сканирующей зондовой микроскопии стала возможность изучения конформации и свойств белков в на уровне отдельной молекулы или группы молекул, а также взаимодействия между ними. Возможность регистрации акта связывания антигена с антителом сможет в будущем заменить иммуноферментный анализ. Рентгеноструктурный анализ кристаллизующихся белков требует создания достаточно крупных кристаллов, а значит, и затрат большого количества белка, что, несомненно, не выгодно с финансовой точки зрения. Туннельная сканирующая микроскопия и спектроскопия открывают возможность изучения электронных свойств белков в изолированном виде и в составе ленгмюровских пленок. В перспективе видится регистрация и управление процессом электронного транспорта в белках, реконструкция и создание искусственных цепей электронного транспорта с последующим созданием на этой базе различных устройств биоэлектроники.
ЛИТЕРАТУРА
Кононенко А.А., Лукашев Е.П., Панов В.И., Федоров Е.А. (1990) Сканирующая туннельная микроскопия функционально активных фрагментов мембран галобактерий, содержащих бактериородопсин// ДАН СССР. 315(5) 1252-1255.
Рашкович Л.Н., Гвоздев Н.В., Яминский И.В. (1998) // в печати.
Alekperov S.D., Vasilyev S.I., Kononenko A.A., Lukashev E.P., Panov V.I., Semenov A.E. (1989) Scanning tunneling microscopy of photosynthetic reaction centers// Chem. Phys. Letts. 164 151-154.
Amrein M., Dьrr R., Stasiak A., Gross H., Travaglini G. (1989) Scanning tunneling microscopy of uncoated recA-DNA complexes// Science. 243 1708-1715.
Bertazzon A., Conti-Troncony B.M., Raftery M.A. (1992) Scanning tunneling microscopy imaging of Torpedo acetylcholine receptor// Proc. Natl. Acad. Sci. USA. 89 9632-9636.
Binnig G., Gerber Ch., Stoll E., Albrecht T.R., Quate C.F. (1987) Atomic resolution with atomic force microscope// Europhys. Lett. 3(12) 1281-1287.
Braunstein D. (1995) Imaging an F-actin structure with noncontact scanning force microscopy// J. Vac. Sci. Technol. A. 13(3) 1733-1736.
Browning-Kelley M.E., Wadu-Mesthrige K., Hari V., Liu G.Y. (1997) Atomic force microscopy study of specific antigen/antibody binding// Langmuir. 13(2) 343-350.
Butt H.J., Downing K.H., Hansma P.K. (1990) Imaging the membrane protein bacteriorodopsin with the atomic force microscope// Biophys. J. 58 1473-1480.
Chernoff E.A., Chernoff D.A. (1992) Atomic force microscope images of collagen fibers// J. Vac. Sci. Technol. A. 10(4) 596-599.
Dahn D.C., Cake K., Hale L.R. (1992) Scanning tunneling microscopy of unbroken chloroplasts// Ultramicroscopy. 42-44 1222-1227.
Dubreuil N., Alexandre S., Foil C., Sommer F., Valleton J.-M. (1995) Characterization of enzymatic structures in mixed Langmuir-Blodgett films by scanning force microscopy// Langmuir. 11(6) 2098-2102.
Dunlap D., Garcнa R., Schabtach E., Bustamante C. (1993) Masking generates contiguous segments of metal-coated and bare DNA for scanning tunneling microscope imaging// Proc. Natl. Acad. Sci. USA. 90 7652-7661.
Durbin S.D., Carlson W.E. (1992) Lysozyme crystal growth studied by atomic force microscopy// Journal of Crystal Growth. 122 71-79.
Edstrom R.D., Meinke M.H., Yang X., Yang R., Evans D.F. (1989) Direct observation of Phosphorylase Kinase and Phosphorylase b by scanning tunneling microscopy// Biochemistry. 28 4939-4942.
Edstrom R.D., Meinke M.H., Yang X., Yang R., Evans D.F. (1990) Scanning tunneling microscopy of the enzymes of muscle glycogenolysis// Ultramicroscopy. 33 99-106.
Facci P., Erokhin V., Nicolini C. (1994) Scanning tunneling microscopy of a monolayer of reaction centers// Thin Solid Films. 234 403-406.
Feng L., Andrade J.D., Hu C.Z. (1989) Scanning tunneling microscopy of proteins on graphite surface// Scanning microscopy. 3(2) 399-410.
Fisher K.A., Whitfield S.L., Thomson R.E., Yanagimoto K.C., Gustafsson M.G.L., Clarke J. (1990) Measuring changes in membrane thickness by scanning tunneling microscopy// Biochemica et Biophysica Acta. 1023 325-334.
Fisher K.A., Yanagimoto K.C., Whitfield S.L., Thomson R.E., Gustafsson M.G.L., Clarke J. (1990) Scanning tunneling microscopy of planar biomembranes// Ultramicroscopy. 33 117-126.
Fritz M., Radmacher M., Cleveland J.P. Allersma M.W., Stewart R.J., Gieselmann R., Janmey P., Schmidt C.F., Hansma P. (1995) Imaging globular and filamentous proteins in physiological buffer solutions with tapping mode atomic force microscopy// Langmuir. 11(9) 3529-3535.
Gallyamov M.O., Ivanov Yu.D., Kiselyova O.I., Uvarov V.Yu., Yaminsky I.V. Local probe microscopy of liposomes and proteoliposomes// in press.
Garcнa R., Garcнa N. (1990) Electron conductance in organic chains: why are STM experiments possible on bare biological samples?// Chem. Phys. Lett. 173 44-50.
Garcнa R., Sбenz J.J., Soler J.M., Garcнa N. (1987) Tunneling current through localized surface states// Sur. Sci. 181 69-77.
Garcнa R., Tamayo J., Soler J.M., Bustamante C. (1995) Physical parameters that control imaging of purple membranes with scanning tunneling microscope// Langmuir. 11(6) 2109-2114.
Gathercole L., Miles M.J., McMaster T.J. (1993) Scanning Probe Microscopy of collagen I and pN-collagen I Assemblies and Relevance to Scanning Tunneling Microscopy Contrast Generation in Proteins// J. Chem. Soc. Faraday Trans. 89(15) 2589-2594.
Golubok A.O., Vinogradova S.A., Tipisev S.Y., Borisov A.Y., Taisova A.S., Kolomytkin O.V. (1992) STM/STS study of photosynthetic bacterial membranes// Ultramicroscopy. 42-44 1228-1235.
Guckenberger R., Heim M., Cevc G., Knapp H.F., Wiegrabe W., Hillebrand A. (1994) Scanning tunneling microscopy of insulators and biological specimens based on lateral conductivity of ultrathin water films// Science. 266 1538-1540.
Guckenberger R., Wiegrabe W., Hillerband A., Hartmann T., Wang Z., Baumeister W. (1989) Scanning tunneling microscopy of a hydrated bacterial surface protein// Ultramicroscopy. 31 327-332.
Gunning A.P., Wilde P.J., Clark D.C., Morris V.J., Parker M.L., Gunning P.A. (1996) Atomic force microscopy of interfacial protein films// Journal of Colloid and Interfacial Science. 183 600-602.
Hansma P.K., Cleveland J.P., Radmacher M., Walters D.A., Hilner P.E., Bezanilla M., Fritz M., Vie D., Hansma H.G., Prater C.B., Massie J., Fukugana L., Gurley J., Elings V. (1994) Tapping mode atomic force microscopy in liquids// Appl. Phys. Lett. 64(13) 1738-1740.
Heckl W.M., Kallury K.M.R., Thompson M. (1989) Characterization of a covalently bound phospholipid on a graphite surface by X-ray photoelectron spectroscopy and scanning tunneling microscopy// Langmuir. 5(6) 1433-1435.
Hinterdorfer P., Baumgartner W., Gruber H.J., Schilcher K., Schilder H. (1996) Detection and localization of individual antibody-antigen recognition events by atomic force microscopy// Proc. Natl. Acad. Sci. USA. 93 3477-3481.
Hoh J.H., Sosinsky G.E., Revel J.-P., Hansma P.K. (1993) Structure of the extracellular surface of the gap junction by atomic force microscopy// Biophys. J. 65 149-163.
Karrasch S., Hegerl R., Hoh J.H., Baumeister W., Engel A. (1994) Atomic force microscopy produces faithful high-resolution images of protein surfaces in an aqueous environment// Proc. Natl. Acad. Sci. USA. 91 836-838.
Keller D., Bustamante C., Keller R.W. (1989) Imaging of single uncoated DNA molecules by scanning tunneling microscopy// Proc. Natl. Acad. Sci. USA. 86 5356-5360.
Konnert J.H., D’Antonio P., Ward K.B. (1994) Oservation of growth steps, spiral dislocations and molecular packing on the surface of lysozyme crystals with the atomic force microscope// Acta Cryst. D50 603-613.
Kuznetsov Yu.G., Malkin A.J., Land T.A., DeYoreo J.J., Barba A.P., Konnert J., McPherson A. (1997) Molecular resolution imaging of macromolecular crystals by atomic force microscopy// Biophys. J. 72 2357-2364.
Land T.A., Malkin A.J., Kuznetsov Yu.G., De Yoreo J.J. (1995) Mechanisms of protein crystal growth: An atomic force microscopy study of canavalin crystallization// Phys. Rev. Lett. 75 2774-2777.
Lee G.U., Kidwell D.A., Colton R.J. (1994) Sensing streptavidin-biotin interactions with atomic force microscopy// Langmuir. 10(2) 354-357.
Lee I., Lee J.V., Warmack R.J., Allison D.P., Greenbaum E. (1995) Molecular electronics of a single photosystem I reaction center: Studies with scanning tunneling microscopy and spectroscopy// Proc. Natl. Acad. Sci. USA. 92 1965-1969.
Lin J.N., Drake B., Lea A.S., Hansma P.K., Andrade J.D. (1990) Direct observation of immunoglobulin adsorption dynamics using the atomic force microscope// Langmuir. 6(2) 509-511.
Lindsay S.M., Sankey O.F., Herbst C., Rupprecht A. (1990) Pressure and resonance effects in STM of molecular organic adsorbates// J. Phys. Chem. 94 4655-4660.
Masai J., Shibata T., Kagawa Y., Kondo Sh. (1992) Imaging of subunit complexes of thermophilic bacterium H+ ATPase with scanning tunneling microscopy// Ultramicroscopy. 42-44 1194-1199.
Masai J., Shibata-Seki T., Ogawa Y., Sato K., Yanagawa H. (1996) Friction force microscopy of petide filament: an application to estimate the size of a supramolecular unit// Thin Solid Films. 281-282 624-629.
McMaster T.J., Miles M.J., Walsby A.E. (1996) Direct observation of protein secondary structure in gas vesicles by atomic force microscopy// Biophys. J. 70 2432-2436.
McPherson A., Malkin A., Kuznetsov Y. (1995) The science of macromolecular crystallization// Structure. 3 759-786.
Meyer G., Zцphel S., Rieder K.H. (1996) Manipulation of atoms and molecules with a low temperature scanning tunneling microscope// Appl. Phys. A. 63 557-564.
Michel B., Travaglini G., Rohrer H., Soachim C., Amrein M. (1989) Images of cristalline alkanes obtained with scanning tunneling microscopy// Zeitschrift fur Physic B. 76 99-105.
Mou J., Czajkovsky D.M., Shao Z. (1996) Gramicidin A aggregation in supported gel state phospatidylcholine bilayer// Biochemistry. 35 3222-3226.
Moy V.T., Florin E.L., Gaub H.E. (1994) Adhesive forces between ligand receptor measured by AFM// Colloids and Surfaces A. 93 343-348.
Mьller D.J., Schabert F.A., Bьldt J., Engel A. (1995) Imaging purple membranes in aqueous solutions at sub-nanometer resolution by atomic force microscopy// Biophys. J. 68 1681-1686.
Niemi H.E.-M., Ikonen M., Levlin J.M., Lemmetyinen H. (1993) Bacteriorhodopsin in Langmuir-Blodgett Films imaged with a scanning tunneling microscope// Langmuir. 9(9) 2436-2447.
Onishi S., Hara M., Furuno T., Okada T., Sasabe H. (1993) Direct visualization of polypeptide shell of ferritin molecule by atomic force microscopy// Biophys. J. 65 573-577.
Onishi S., Hara M., Furuno T., Sasabe H. (1996) Imaging two-dimentional crystals of catalase by atomic force microscopy// Jpn. J. Appl. Phys. 35 6233-6238.
Perrin A., Lanet V., Theretz A. (1997) Quantification of specific immunological reactions by atomic force microscopy// Langmuir. 13(9) 2557-2563.
Rдdler J., Radmacher M., Gaub H.E. (1994) Velocity-dependent forces in atomic force microscopy imaging of lipid films// Langmuir. 10(9) 3111-3115.
Radmacher M., Fritz M., Cleveland J.P., Walters D.A., Hansma P.K. (1994) Imaging adhesion forces and elasticity of lisozyme adsorbed on mica with the atomic force microscope// Langmuir. 10(10) 3809-3814.
Radmacher M., Fritz M., Hansma H.G., Hansma P.K. (1994) Direct observation of enzyme activity with the atomic force microscope// Science. 265 1577-1579.
Ruppersberg J.P., Horber J.K.H., Gerber C., Binnig G. (1989) Imaging cell membraneous and cytoskeletal structures with a scanning tunneling microscope// FEBS Lett. 257 460-464.
Tamayo J., Sбenz J.J., Garcнa R. (1995) Scanning tunneling microscopy modification of purple membranes// J. Vac. Sci. Technol. A. 13(3) 1737-1741.
Tang S.L., McGhie A.J., Suna A. (1993) Molecular-resolution imaging of insulating macromolecules with the scanning tunneling microscope via a nontunneling, electric-field-induced mechanism// Phys. Rev. B. 47 3850-3856.
Thomson N.H., Fritz M., Radmacher M., Cleveland J.P., Schmidt C.F., Hansma P.K. (1996) Protein tracking and detection of protein motion using atomic force microscopy// Biophys. J. 70 2421-2431.
Umemura K., Arawaka H., Ikai A. (1993) High resolution images of cell surface using a tapping-mode atomic force microscope// Jpn. J. Appl. Phys. 32 L1711-L1714.
Uvarov V.Yu., Ivanov Yu.D., Romanov A.N., Gallyamov M.O., Kiselyova O.I., Yaminsky I.V. (1996) Scanning tunneling microscopy study of cytochrome P450 2B4 incorporated in proteoliposomes// Biochimie. 78 780-784.
Van der Werf K.O., Putman C.A.J., Grooth B.G., Greve J. (1994) Adhesion force imaging in air and liquid by adhesion force mode atomic force microscope// Appl. Phys. Lett. 65 1195-1197.
Weisenhorn A.L., Drake B., Prater C.B., Gould S.A.C., Hansma P.K., Ohnesorge F., Egger M., Heyn S.-P., Gaub H.E. (1990) Immobilized proteins in buffer solution at molecular resolution by atomic force microscopy// Biophys. J. 58 1251-1258.
Wiegrдbe W., Nonnenmacher M., Guckenberger R., Wolter O. (1991) Atomic force microscopy of a hydrated bacterial surface protein// J. of Microscopy. 163 Pt 1, 79-84.
Worcester D.L., Kim H.S., Miller R.G., Bryant P.J. (1990) Imaging bacteriorodopsin lattices in purple membranes with atomic force microscopy// J. Vac. Sci. Technol. A. 8(1) 403-405.
Worcester D.L., Miller R.G., Bryant P.J. (1988) Atomic force microscopy of purple membranes// J. of Microscopy. 152 Pt 3 817-821.
Yamada H., Hirata Y., Miyake J. (1995) Atomic force microscopy studies of photosynthetic protein membrane Langmuir-Blodgett films// J. Vac. Sci. Technol. A. 13(3) 1742-1745.
Yang J., Mou J., Shao Z. (1994a) Molecular resolution atomic force microscopy of soluble proteins// Biochem. Biophys. Acta. 1199 105-114.
Yang J., Mou J., Shao Z. (1994b) Structure and stability of pertussis toxin studied by in situ atomic force microscopy// FEBS Lett. 338 89-92.
Yang J., Takeyasu K., Somlyo A.P., Shao Z. (1992) Scanning tunneling microscopy of an ionic crystal: ferritin core// Ultraicroscopy. 45 199-203.
Yang J., Tamm L.K., Tillack T.H., Shao Z. (1993) New approach for atomic force microscopy of membrane proteins// J. Mol. Biol. 229 286-290.
Yuan J.Y., Shao Z. (1990) Simple model of image formation by scanning tunneling microscopy of non-conducting materials// Ultramicroscopy. 34 223-226.
Yuan J.Y., Shao Z., Gao C. (1991) Alternative method of imaging surface topologies of nonconducting bulk specimens by scanning tunneling microscopy// Phys. Rev. Lett. 67 863-866.
Zhang B., Wang E. (1997) Tip-induced dynamic characterization of multilayers and variable morphologies of cytochrome c molecules on highly oriented pyrolytic graphite revealed by in-situ scanning tunneling microscopy// J. Chem. Soc. Faraday Trans. 93(2) 327-331.
Zhang J., Chi Q., Dong S., Wang E. (1995) STM of folded and unfolded haemoglobin molecules electrochemicallya deposited on highly oriented pyrolytic graphite// J. Chem. Soc. Faraday Trans. 91(10) 1471-1475.
Zhang J., Chi Q., Dong S., Wang E. (1996) In situ electrochemical scanning tunneling microscopy investigation of structure for horseradish peroxidase and its electrocatalytic property// Biochemistry and Bioenergetics. 39 267-274.
Zhu X.-Y., Poirler G.E., White J.M. (1991) Scanning tunneling microscopy of collagen molecules// J. Vac. Sci. Technol A. 9(2) 179-181.